Chuyên mục
| Đang trực tuyến : | 1535 |
| Tổng truy cập : | 57,998 |
Khoa học - Y dược
Liệu pháp ung thư không xâm lấn: Một cách tiếp cận mới sử dụng ánh sáng NIR-III (31/03/2021)
Mới đây, các nhà khoa học ĐH Quốc gia Thành Công (Đài Loan) đã lần đầu tiên sử dụng ánh sáng cửa sổ sinh học cận hồng ngoại thứ ba (viết tắt NIR-III, bước sóng 1500-1700nm) để kích hoạt hạt nano mang hai chất nhạy quang cho liệu pháp quang động lực dựa trên hạt nano (viết tắt PDT) nhằm tiêu diệt tế bào ung thư.

Tiến sĩ Phạm Yên Khang.
Mới đây, TS Phạm Yên Khang cùng các đồng nghiệp tại phòng thí nghiệm Nano-Odyssey, Khoa Hóa học, ĐH Quốc gia Thành Công (Đài Loan) đã lần đầu tiên sử dụng ánh sáng cửa sổ sinh học cận hồng ngoại thứ ba (viết tắt NIR-III, bước sóng 1500-1700nm) để kích hoạt hạt nano mang hai chất nhạy quang cho liệu pháp quang động lực dựa trên hạt nano (viết tắt PDT) nhằm tiêu diệt tế bào ung thư, mở ra hướng nghiên cứu mới về sử dụng ánh sáng NIR-III cho liệu pháp ung thư không xâm lấn mà không ảnh hưởng đến tế bào lành. Công trình nghiên cứu được đăng trên tạp chí khoa học uy tín Journal of Materials Chemistry B thuộc Hội hóa học Hoàng gia Anh và được ban biên tập bình chọn là “HOT paper”.
Tìm kiếm “nước sông Styx” cho “gót chân Achilles”
Sự phát triển nhanh chóng của khoa học và công nghệ nano đã cho ra đời phương pháp điều trị ung thư mới, liệu pháp quang động lực dựa trên hạt nano (photodynamic therapy-PDT. Đầu tiên, chất nhạy quang (photosensitizer) được đưa đến vị trí khối u bằng hạt nano. Sau đó, chiếu tia laze có bước sóng thích hợp vào khối u. Chất nhạy quang sau khi hấp thụ bức xạ laze sẽ tạo ra các tiểu phân oxy có hoạt tính cao (viết tắt ROS, hay gặp là 1O2). Những tiểu phân này tiêu diệt tế bào ung thư, cuối cùng dẫn đến phá hủy khối u ung thư.
Theo cơ chế này, liệu pháp PDT là một dạng điều trị không xâm lấn. Nói cách khác, các bác sĩ không cần rạch cơ thể hoặc cắt bỏ mô, mà chỉ cần kích hoạt phản ứng tạo ra ROS bằng tia laze. Thêm vào đó, điều làm nên ưu thế của PDT là các thành phần riêng lẻ của nó (gồm ánh sáng laze, chất nhạy quang, oxy) đều không độc, chúng chỉ tạo ra ROS gây độc tế bào khi kết hợp với nhau tại vị trí khối u. Do những ưu điểm này, PDT có khả năng chọn lọc cao, chỉ tiêu diệt tế bào ung thư mà không ảnh hưởng đến tế bào lành, giảm tối đa tác dụng phụ khi so sánh với những phương pháp vẫn sử dụng phổ biến hiện nay như hóa trị và xạ trị.
Mặc dù liệu pháp PDT đầy hứa hẹn trong việc tiêu diệt khối u và nâng cao chất lượng cuộc sống bệnh nhân, nhưng các nhà khoa học vẫn phải đối mặt với một thách thức: Ánh sáng kích chất nhạy quang sinh ra ROS là ánh sáng UV/vis có độ thâm nhập mô chỉ vài milimet, không thể tới được các khối u nằm sâu trong cơ thể. Để ánh sáng UV/vis đến được chỗ khối u nằm sâu hơn dưới da thì các nhà khoa học cần phải tìm ra ánh sáng có độ thâm nhập mô sâu hơn. Do chưa thể vượt qua được thách thức này nên độ sâu thâm nhập mô kém của ánh sáng UV/vis đã trở thành điểm yếu cốt lõi, hay còn gọi là ‘gót chân Achilles’ của liệu pháp PDT truyền thống. Người ta vẫn chờ đợi tới ngày tìm được giải pháp để nâng cao hiệu quả của liệu pháp PDT trên nhiều loại ung thư khác nhau, thay vì giới hạn ở việc điều trị một số loại ung thư, mà hầu hết là ung thư da, như hiện nay.
Cũng giống như các đồng nghiệp quốc tế, thách thức này là điều mà TS Phạm Yên Khang và các đồng nghiệp tại phòng thí nghiệm Nano-Odyssey, khoa Hóa học, Đại học quốc gia Thành Công (National Cheng Kung University - NCKU) Đài Loan vẫn luôn trăn trở. Achilles là một á thần, ranh giới giữa sự bất tử vĩnh hằng của thần thánh và một phàm nhân như anh là nơi gót chân không được nhúng nước sông Styx. Hệt như vậy, nếu không vượt qua được ranh giới về độ sâu thâm nhập mô, liệu pháp PDT sẽ có thể vĩnh viễn dừng lại ở vị trí là một phương pháp điều trị ung thư da.
Những tưởng nhóm nghiên cứu của TS Phạm Yên Khang sẽ phải đối diện với thất bại như các đồng nghiệp quốc tế của mình, nhưng rồi họ đã tìm ra được ‘nước sông Styx’ để khắc phục điểm yếu đó: ánh sáng thuộc cửa sổ sinh học cận hồng ngoại thứ ba (NIR-III). “NIR-III không phải là một hướng nghiên cứu quá mới”, TS Phạm Yên Khang chia sẻ. “Năm 2015, nhóm nghiên cứu của GS Hongjie Dai ở Đại học Stanford đã lần đầu tiên sử dụng ánh sáng thuộc vùng NIR-III phát xạ từ vật liệu bán dẫn ống nano carbon đơn vách để tiến hành chụp ảnh huỳnh quang của mạch máu não chuột”.
“Độ thâm nhập mô sâu” - đó là một cụm từ vô cùng quan trọng. Các nhà khoa học khắp nơi trên thế giới vô cùng hào hứng với những ưu điểm của ánh sáng này – cho hình ảnh huỳnh quang phân giải cao gần như không bị nhiễu nền, và có độ thâm nhập mô sâu, thậm chí họ gọi NIR-III là “golden window” - cửa sổ vàng. Tuy nhiên, họ mới chỉ nhìn nhận khả năng thâm nhập mô sâu của NIR-III trong lĩnh vực chụp ảnh huỳnh quang, còn TS Phạm Yên Khang và các cộng sự của mình đã nhận ra rằng NIR-III chính là ‘cửa sổ vàng’ để hóa giải gót chân Achilles, bởi ánh sáng này có độ thâm nhập mô sâu hơn hẳn ánh sáng trong vùng UV/vis.
“Đối lập hoàn toàn với sự phát triển nhanh chóng của lĩnh vực hình ảnh huỳnh quang, cho đến nay chưa có nghiên cứu nào sử dụng ánh sáng NIR-III cho mục đích điều trị ung thư, cụ thể là PDT. Điều đó gợi ý chúng tôi tiến hành thử nghiệm liệu pháp PDT sử dụng ánh sáng NIR-III”, TS Phạm Yên Khang nhớ lại. Và thế là vào năm 2017, dưới sự dẫn dắt của GS Chen-Sheng Yeh, trưởng khoa Hóa học đồng thời là Chủ tịch Hội nano y sinh Đài Loan, anh và các đồng nghiệp đã bắt tay vào thử nghiệm ý tưởng mới này.
Tăng hiệu quả tiêu diệt tế bào ung thư
Dù đã chuẩn bị suy nghĩ rằng đây là một nghiên cứu liên ngành nên sẽ không có một công đoạn nào… dễ dàng cả, nhưng nhóm nghiên cứu vẫn bất ngờ khi phải trải qua nhiều đêm thức trắng ở phòng thí nghiệm để giải những câu hỏi mới liên tục nảy ra trong thời gian thử nghiệm.
Dù là một ứng viên tiềm năng, nhưng việc chiếu trực tiếp ánh sáng NIR-III vào chất nhạy quang lại dẫn đến trở ngại khác: năng lượng thấp của ánh sáng NIR-III không đủ hiệu quả để tạo ra lượng ROS cần thiết nhằm gây chết tế bào. Câu hỏi mới mà giờ đây nhóm nghiên cứu phải đối diện, đó là làm thế nào tận dụng được độ thâm nhập mô sâu của ánh sáng NIR-III mà vẫn tạo ra đủ lượng ROS cần thiết? “Chúng tôi nhận ra rằng vật liệu nano phát quang ngược (UNCPs) là một giải pháp tốt”, TS Khang cho biết. “Vật liệu UCNPs có một tính chất độc đáo, đó là khả năng chuyển đổi ánh sáng năng lượng thấp, có bước sóng dài (thường trong vùng cận hồng ngoại - NIR) sang bức xạ có năng lượng cao hơn, bước sóng ngắn hơn (thường trong vùng UV/vis). Do đó, vật liệu UCNPs mở ra khả năng kích thích chất nhạy quang bằng ánh sáng NIR-III để tận dụng độ thâm nhập mô sâu của loại ánh sáng này”, anh giải thích.
Thay vì đi vào ngõ cụt, nhóm nghiên cứu đã tìm ra vật liệu UNCPs, và thậm chí đã nảy ra ý tưởng sử dụng hai loại chất nhạy quang khác nhau là RB và Ce6 để tạo ra lượng ROS dồi dào nhằm năng cao hiệu suất PDT. “Vật liệu nano của chúng tôi dưới kích thích 1550 nm có khả năng phát xạ đồng thời ra ánh sáng xanh (548 nm) và đỏ (666 nm) với cường độ không khác nhiều. Do đó, nếu chỉ sử dụng một loại chất nhạy quang thì chỉ hấp thụ được 1 trong 2 ánh sáng trên, và sẽ lãng phí ánh sáng còn lại. Vì vậy, chúng tôi sử dụng hai loại chất nhạy quang để không bỏ phí phát xạ nào, đồng thời tăng lượng ROS để tăng hiệu quả tiêu diệt tế bào ung thư”, TS Khang cho hay.
Việc sử dụng hai chất nhạy quang khác nhau để tăng lượng ROS không phải là một ý tưởng mới, vì đã có những nhóm nghiên cứu khác sử dụng. “Tuy nhiên, bên cạnh sự khác biệt về thành phần và thiết kế, cái mới ở đây là chúng tôi sử dụng ánh sáng kích thích 1550 nm (để lợi dụng khả năng thâm nhập mô sâu của nó), và tận dụng khả năng sinh dồi dào ROS khi dùng hai chất nhạy quang”, anh giải thích.
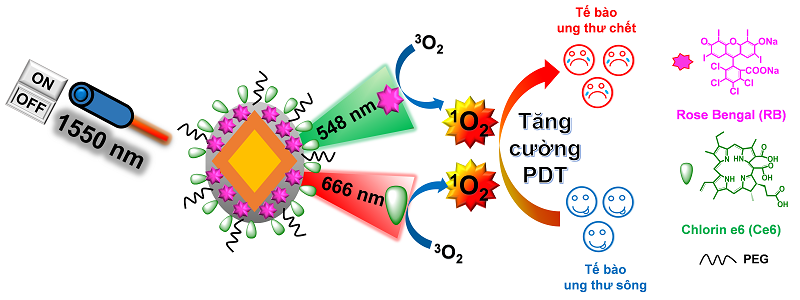
Sơ đồ minh họa cơ chế liệu pháp PDT dựa trên vật liệu nano phát quang ngược (UCNPs) mang chất nhạy quang kép. Hạt nano UCNPs (kích thước khoảng 43 nm) được bọc bởi vỏ silica (màu xám), sau đó hai chất nhạy quang là RB và Ce6 được tải lên vỏ silica này. Dưới kích thích của laze bước sóng 1550 nm, hạt nano UCNPs sẽ chuyển ánh sáng kích thích thành hai bức xạ mới có bước sóng 548 nm và 666 nm. Hai loại bức xạ sẽ được hấp thụ đồng thời bởi chất nhạy quang RB và Ce6 tương ứng. Việc kích thích hai chất nhạy quang cùng lúc tạo ra lượng singlet oxygen (1O2) dồi dào, tiêu diệt nhiều tế bào ung thư hơn, từ đó tăng hiệu quả liệu pháp PDT.
Với thiết kế độc đáo như trên, nhóm nghiên cứu đã thử nghiệm in vitro trên dòng tế bào ung thư tuyến tụy (PANC-1). Kết quả cho thấy, liệu pháp PDT mới (kết hợp hai loại chất nhạy quang khác nhau và sử dụng ánh sáng kích thích bước sóng 1550 nm) đã tiêu diệt được hơn 70% tế bào ung thư chỉ sau khi chiếu laze 10 lần, mỗi lần 30 giây. “Thử nghiệm in vivo trên chuột bạch mang khối u đã cho thấy sự giảm đáng kể kích thước khối u sau ba tuần chỉ với 1 liều nano duy nhất”, TS Phạm Yên Khang cho hay. Với vai trò là tác giả chính của nghiên cứu, anh bày tỏ sự vui mừng khi so sánh nghiên cứu của mình với những công trình khác sử dụng liệu pháp PDT, “nghiên cứu của chúng tôi có ưu điểm hơn ở chỗ là thời gian chiếu laze ngắn hơn, và chỉ dùng 1 liều duy nhất là đã có hiệu quả rõ rệt (thông thường 1-3 liều)”.
Gợi mở khả năng phát triển và ứng dụng
“Hệt như một trận bóng, và chúng tôi đã ghi bàn”, TS Phạm Yên Khang ví von khoảnh khắc nhóm nghiên cứu nhận được tin ban biên tập tạp chí Journal of Materials Chemistry B (JMCB) chấp nhận xuất bản nghiên cứu, và thậm chí do tính tiên phong của công trình nên họ đã bình chọn đây là “HOT paper”.
Dù đáng lý nhóm nghiên cứu có thể công bố công trình của mình trên một tạp chí thuộc hàng nhất, nhì về lĩnh vực khoa học nano, nhưng vì muốn được công bố sớm để giữ tính tiên phong của đề tài, họ đã quyết định xuất bản trên JMCB - một tạp chí khoa học uy tín khác.
Với TS Phạm Yên Khang, đây thực sự là “trái ngọt”, bởi “nghiên cứu này đã kéo dài hơn ba năm với rất nhiều thí nghiệm, và bản thân tôi luôn phải chuẩn bị một tinh thần đặc biệt vững để đối mặt với thất bại bất kỳ lúc nào, đặc biệt là đối với một nghiên cứu khó như liệu pháp điều trị ung thư”, anh chia sẻ.
Tuy nhiên, với nhóm nghiên cứu, đây mới chỉ là thành công bước đầu, họ vẫn đang tiếp tục hoàn thiện và tối ưu hóa phương pháp của mình. Cụ thể, theo TS Khang, để hoàn thiện hơn và tối ưu hóa phương pháp, nhóm cần giải quyết vấn đề nồng độ oxy thấp của tế bào khối u ung thư (đặc tính hypoxia) cũng như gắn thêm các phân tử hướng đích chủ động để vật liệu nano đến được khối u nhiều hơn. Ngoài ra, để đi xa hơn như chữa trị trên người, nhóm cần phải làm rất nhiều việc, vì đây mới chỉ dừng lại là nghiên cứu cơ bản.
Nguồn: tiasang.com.vn
Ngày cập nhật: 29/03/2021
- Virus cúm H5N1 bất hoạt trong sữa thanh trùng chỉ gây ra rủi ro sức khỏe ở mức tối... (17/12/2025)
- Liệu pháp ánh sáng mới tiêu diệt 92% tế bào ung thư da mà không gây hại cho mô khỏe... (14/12/2025)
- Xét nghiệm máu lần đầu tiên phát hiện hội chứng mệt mỏi mãn tính (03/12/2025)
- Ống nghe thông minh: sự kết hợp giữa truyền thống và trí tuệ nhân tạo trong phát... (28/11/2025)
- Gel kích hoạt bằng tia X tiêu diệt nhiễm trùng sâu trong mô mà không cần kháng sinh (19/11/2025)
- Hạt nano điều trị ung thư chính xác, ít độc hại (13/11/2025)












