Chuyên mục
| Đang trực tuyến : | 2499 |
| Tổng truy cập : | 57,998 |
Thông tin kết quả nhiệm vụ KH&CN
Nghiên cứu phát triển kỹ thuật PCR đa mồi (multiplex PCR) để phát hiện nhanh một số vius gây bệnh đường hô hấp ở gà tại miền Bắc Việt Nam (18/10/2024)
Bệnh đường hô hấp là những bệnh truyền nhiễm thường gặp và nguy hiểm trong chăn nuôi gia cầm do tỷ lệ chết cao có thể xảy ra ở nhiều trường hợp mắc bệnh. Nguyên nhân gây bệnh do virus và vi khuẩn. Trong chăn nuôi, các loại gia cầm mắc bệnh sẽ gây thiệt hại đáng kể về mặt kinh tế như giảm tăng trọng, giảm sản lượng và chất lượng trứng, tăng tỷ lệ chết, giảm chất lượng thịt…
Việc chẩn đoán dựa vào triệu chứng lâm sàng và bệnh tích thường khó phân biệt được các nguyên nhân gây bệnh. Hơn nữa, sử dụng phương pháp khuếch đại gene đơn lẻ có thể thiếu sót mầm bệnh dẫn đến sai lệch trong biện pháp phòng chống bệnh. Việc tiến hành nhiều phản ứng PCR đơn lẻ để cẩn đoán bệnh cũng làm kinh phí xét nghiệm tăng cao. Trong khi đó, kỹ thuật multiplex PCR đa mối là một trong những phản ứng đã được sử dụng chẩn đoán nhằm khuếch đại nhiều trình tự gene chỉ trong một phản ứng. Phương pháp này sẽ rút ngắn thời gian thực hiện giúp chẩn đoán nhanh và chính xác cùng lúc một số nguyên nhân gây bệnh, từ đó giảm chi phí xét nghiệm chẩn đoán bệnh.
Từ nhu cầu thực tế của người chăn nuôi, việc chẩn đoán nhanh và phát hiện chính xác nguyên nhân gây bệnh ở trang trại vô cùng cần thiết để sớm có biện pháp kiểm soát dịch bệnh đạt hiệu quả tốt hơn. Do vậy, Học viện nông nghiệp Việt Nam đã tiến hành triển khai đề tài Nghiên cứu phát triển kỹ thuật PCR đa mồi (multiplex PCR) để phát hiện nhanh một số vius gây bệnh đường hô hấp ở gà tại miền Bắc Việt Nam do TS Trần thị Hương Giang làm chủ nhiệm, đề tài thực hiện từ tháng 1/2022-12/2023.
Để phát hiện nhanh một số virus gây bệnh đường hô hấp gồm NDV,ILTV,IBV và aMPV, nhóm nghiên cứu đã sử dụng các phương pháp nghiên cứu đó là: Phương pháp xử lý mẫu: Mẫu được đồng nhất theo tỷ lệ 10% với dung dịch đêm PBS 1X. Đối với mẫu phủ tạng sau khi được trộn theo tỷ lệ 1/10 được đông tan 3 lần, và ly tâm ở điều kiện 3.000 vòng/phút/ 10 phút ở 4oC. Thu phần dịch trong suốt ở pha trên chuyển sang ống eppendort sạch vô trùng đã xử lý Rnase. Mẫu sau đó được bảo quản ở nhiệt độ -30oC tới khi sử dụng; Phương pháp kiểm tra cặp mồi cho phản ứng mPCR: Các tổ hợp mồi cho phản ứng RT-PCR/PCR, mPCR được tham khảo từ những nghiên cứu trước đây hoặc được thiết kế để khuếch đại vùng gen đích của NDV,ILTV,IBV và aMPV bằng phần mềm Prinmer3 với tiêu chí tránh tạo sản phẩm phụ primer-dimer; Phương pháp tách ARN/AND, tổng hợp complementary DNA (cDNA); Phương pháp RT-PCR/PCR; Phương pháp mPCR: Phản ứng mPCR được thực hiện với các cặp mồi đặc hiệu đã được tối ưu hóa các điều kiện thích hợp cho phản ứng PCR đơn. Phản ứng mPCR được thực hiện với chu trình nhiệt như sau 95oC trong 5 phút, 35 vòng với chu trình 95oC trong 30 giây, nhiệt độ gắn mồi (50-60oC tùy vào kết quả tối ưu hóa) trong 30 giây, 72oC trong 40 giây và 72oC trong 2 phút. Sản phẩm PCR được điện di trên thạch agarose 1,2%; Phương pháp xác định hộ đặc hiệu của phản ứng mPCR; Phương phapsxacs định ngưỡng phát hiện của phản ứng mPCR; Xử lý số liệu để đo lường sự thống nhất giữa kết quả mPCR và PCR.

Quy trình phản ứng PCR đơn.
Nhóm nghiên cứu đã lựa chọn được 4 cặp mồi để pháp triển phản ứng mPCR phát hiện 4 loại ARN/ADN của NDV,ILTV,IBV và aMPV gây bệnh đường hô hấp ở gà đảm bảo các tiêu chí về chiều dài mồi, nhiệt dột nóng chảy của các mồi không quá chênh lệch, đặc biệt không có khả năng bắt chéo nhau, cụ thể: Các cặp mồi có thể bám trên 100 trình tự gen đầu tiên tìm được đều thuộc về NDV, ILTV, IBV và aMPV trong GenBank. Sự bắt cặp hoàn toàn giữa các cặp mồi này với các trình tự gene NDV, ILTV, IBV và aMPV được thể hiện qua các chỉ số tương đồng nucleotide (100%), Gaps (0),… Từ kết quả kiểm tra thu được, cặp mồi có thể bắt cặp tốt gene E của các chủng NDV, gene thymidine kinase của các chủng ILTV, gene S1 của các chủng IBV và gene nucleoprotein (N) của aMPV. Các cặp mồi được lựa chọn để phát hiện NDV, ILTV, IBV và aMPV được kiểm tra một số tiêu chí như: tránh tạo sản phẩm phụ primer-dimer; đặc trưng cho trình tự AND cần khuếch đại; chiều dài của mồi khoảng 8-10 nucleotide; nhiệt độ nóng chảy; thành phần GC của đoạn mồi; nhiệt độ nóng chảy của mồi xuôi và mồi ngược không quá cách xa nhau để đảm bảo mồi có nhiệt độ biến tính lai được với AND chuẩn. Các độ dài đoạn mồi được lựa chọn trong khoảng 18-22 nucleotide; nhiệt độ gắn mồi dao động từ 46,5oC - 58,6oC, chủ yếu nằm trong khoảng 3oC-5oC, riêng có mồi xuôi xác định aMPV có nhiệt độ gắn mồi ở 58,6oC; tỷ lệ C+G của các đoạn mồi được xác định từ 33,3-59,1%. Bên cạnh đó, các đoạn mồi được lựa chọn không có khả năng hình thành dimer-primer, hơn nữa khi kiểm tra các oligo của các đoạn mồi cho thấy giữa chúng không có phản ứng chéo với nhau.
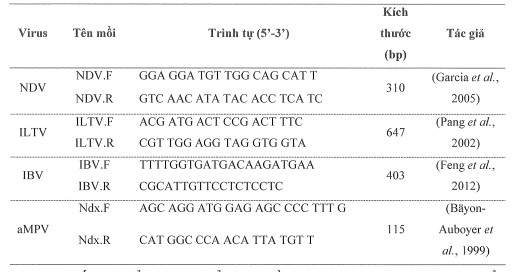
Trình tự cặp mồi cho phản ứng mPCR.
Để thực hiện phản ứng PCR kiểm tra sự bắt cặp của các cặp mồi, chủng virus vắc-xin đại diện cho NDV, ILTV, IBV và aMPV được dùng làm đối chứng dương. Phản ứng PCR được thực hiện ở các nhiệt độ bắt mồi khác nhau (gradient nhiệt độ được cài đặt trong dải 50oC-60oC, mỗi điều kiện gắn mồi đều được thử nghiệm với lượng mẫu giống nhau, nồng độ mồi phản ứng là 0,5 pmol/µl). Kết quả tính bắt cặp của mồi với các chủng đối chứng dương cho kết quả bắt cặp tốt nhất ở nhiệt độ bắt mồi 50oC-55oC với cặp mồi phát hiện NDV, ILTV, IBV và aMPV, riêng với cặp mồi IBV, sản phẩm PCR được khuếch đại tốt nhất ở nhiệt độ gắn mồi 53oC-55oC. Kết quả tối ưu hóa của phản ứng PCR thực hiện ở nhiệt độ gắn mồi ở 55oC, nồng độ mồi phản ứng là 0.5pmol/µl để phát hiện 4 loại mầm bệnh do virus gây ra ở gà NDV, ILTV, IBV và aMPV cho sản phẩm PCR khuếch đại tốt.
Bên cạnh đó, nhóm nghiên cứu tiến hành trên 208 mẫu bệnh phẩm thu thập được của gà nghi mắc bệnh đường hô hấp tại 6 tỉnh/thành phố miền Bắc Việt Nam: Hà Nội, Thái Nguyên, Hải Phòng, Bắc Ninh, Hải Dương, Phú Thọ. Tất cả các mẫu bệnh phẩm thu được tại các cơ sở chăn nuôi đã tiêm vacxin phòng bệnh do NDV và IBV gây ra. Các đàn gà được khảo sát chủ yếu là gà trắng hướng thịt với quy mô đàn từ 1.000-8.000 con. Cùng với đó, tất cả gà nghi bệnh đều ủ rũ, còi cọc và có biểu hiện khò khè, ho, chảy dịch ở đường hô hấp. Mẫu bệnh phẩm gà thu thập sau khi được đồng nhất và xử lý tách chiết DNA/RNA được xác định hệ gen của NDV bằng phản ứng PCR với cặp mồi chẩn đoán NDV.F/F với sản phẩm khuếch đại 310 bp. Tỷ lệ dương tính với vật liệu di truyền của NDV. Kết quả cho thấy, phản ứng PCR xác định được 23/208 mẫu dương tính với vật liệu di truyền của NDV. Những mẫu dương tính với vật liệu di truyền của NDV trong nghiên cứu này được phát hiện ở những mẫu gộp phủ tạng.
Kết quả của phản ứng mPCR và phản ứng PCR khi thực hiện kiểm tra 208 mẫu thu nhập thực địa thấy rằng phản ứng mPCR có độ nhạy (100%) và độ đặc hiệu (100%) so với phản ứng PCR. Hơn nữa, hệ số đồng thuận Coben’s Kappa đại diện cho mức độ chính xác và độ tin cậy trong phân loại thống kê cũng được tính toán để đo lường sự thống nhất giữa kết quả mPCR và RT-PCR/PCR trong nghiên cứu này. Khi so sánh kết quả của 2 phản ứng này giá trị hệ số này bằng 1 cho thấy sự đồng thuận về mức độ chính xác và tin cậy của phản ứng mPCR khi kiểm tra phát hiện gene của 4 loại virus trong mẫu bệnh phẩm.
Kết quả bước đầu ứng dụng cho thấy phản ứng mPCR có thể tiết kiệm được thời gian và chi phí trong thực tiễn chẩn đoán bệnh đường hô hấp ở gà. Tuy nhiên, nhóm nghiên cứu chưa phát hiện mẫu nào đồng dương tính với gene của ILTV, IBV và aMPV. Như vậy, Phản ứng MPCR sử dụng 4 cặp mồi với nồng độ sử dụng là 0,1 pmol/ul được thực hiện ở nhiệt độ gắn mồi 55oC với ngưỡng xác định phản ứng mPCR có thể xác định được sự có mặt của NDV ở hiệu giá virus 100.6 EID50/ml, ILTV ở hiệu giá virus 100.5 EID50/ml và aMPV ở hiệu quả virus 100.4 CCID50/ml. Đã thực hiện thành công phản ứng mPCR đối với 208 mẫu bệnh phẩm, trong đó phát hiện 7/208 mẫu đồng nhiễm NDV và ILTV và 5/208 mẫu đồng nhiễm NDV và IBV.
Có thể tìm đọc toàn văn Báo cáo kết quả nghiên cứu dự án tại Trung tâm Thông tin và Thống kê Khoa học và Công nghệ./.
- Nghiên cứu quy trình sản xuất tinh bột giàu tinh bột kháng từ chuối tiêu phục vụ... (19/12/2025)
- Nghiên cứu xây dựng mô hình thử nghiệm sản xuất giống và nuôi thương phẩm cầu gai... (17/12/2025)
- Nghiên cứu đề xuất giải pháp bảo tồn và phát huy giá trị các di tích khảo cổ trên... (15/12/2025)
- Xây dựng mô hình sản xuất thương phẩm giống ngô nếp lai HN92 trên địa bàn tỉnh Hải... (12/12/2025)
- Xây dựng mô hình sản xuất thương phẩm giống lúa nếp KING 6 trên địa bàn tỉnh Hải... (11/12/2025)
- Hỗ trợ hoạt động của các tổ chức huấn luyện, bồi dưỡng kiến thức nâng cao về khởi... (10/12/2025)












